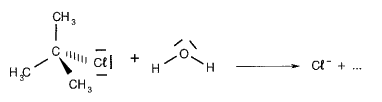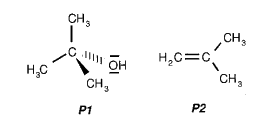|
Dans un futur lointain, des lycéens d’un centre étranger, éloigné dans la galaxie, se rendent dans leur futur lycée après avoir passé leurs vacances d’été sur Terre. Ils s’aperçoivent qu’ils effectuent leur trajet en navette avec leur nouvel enseignant de sciences physiques. Pour passer le temps, celui-ci propose à ses futurs élèves de s’avancer dans le cours de terminale S.
Ils s’intéressent à la réaction chimique entre l’eau et le 2-chloro-2méthylpropane :
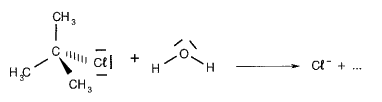
On rappelle que dans le modèle de la représentation de Lewis, une liaison covalente est représentée par un trait entre deux atomes et qu’un doublet non-liant est représenté par un trait localisé sur un atome. Les trois parties de cet exercice sont largement indépendantes entre elles. La première partie permet de trouver la nature de la réaction après une analyse de spectres IR et de RMN du proton, la seconde partie est une étude cinétique de la réaction, la troisième partie traite de la relativité restreinte.
1. Étude de la transformation chimique
1.1. Préciser les polarités de la liaison C – Cl dans le 2-chloro-2-méthylpropane et des liaisons O-H dans l’eau, en utilisant les données d’électronégativité ci-dessous :
χ(H) = 2, 20 ; χ(C) = 2,55 ; χ(Cl) = 3,16 ; χ(O) = 3,44.
1.2. À l’aide des formules de Lewis de l’eau et du 2-chloro-2méthylpropane données précédemment, identifier les sites donneurs et accepteurs d’électrons pouvant être mis en jeu dans cette réaction.
1.3. La réaction chimique entre l’eau et le 2-chloro-2-méthylpropane peut conduire à deux produits par une substitution ou une élimination. Attribuer à chaque molécule représentée ci-dessous, le type de réaction en le justifiant.
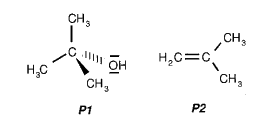
Afin de connaître le produit de réaction formé, P1 ou P2, ses spectres IR et de RMN du proton sont effectués.
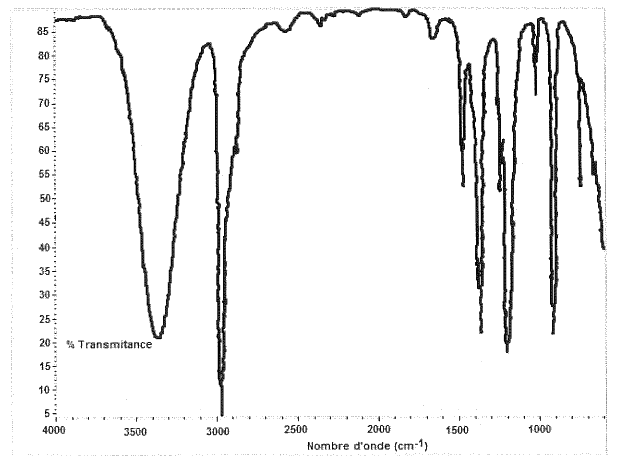
1.4. À partir du spectre IR fourni sur le document 1 de l’annexe, indiquer la présence ou l’absence de chaque groupe caractéristique mentionné dans le tableau ci-dessous.
| Groupe | O – H(1) | C – H(2) | C – H(3) | C = C |
| Nombre d’onde (cm-1) | 3200 - 3400 | 3000 - 3100 | 2810 - 3000 | 1620 - 1680 |
(1) Alcool avec liaisons H
(2) C lié à une double liaison
(3) C ayant quatre liaisons covalentes simples
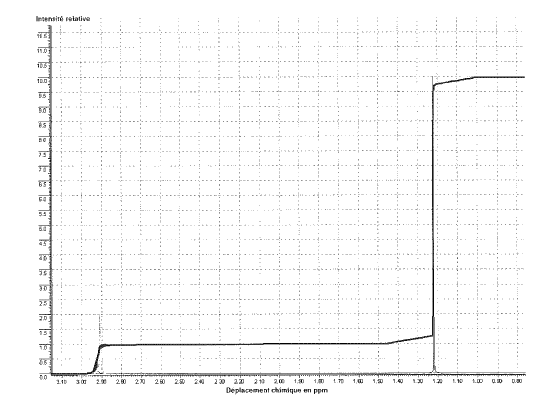
1.5. Identifier le produit de la réaction P1 ou P2 à partir du spectre de RMN du proton fourni en document 2 de l’annexe 1 et en utilisant éventuellement les résultats de la question 1.4.
| Proton | C = CH2 | C – O – H | CH3 – C = C | CH3– C – O |
| Déplacement chimique δ (ppm) | 4,5 à 6 | 0,7 à 5,5(1) | 1,6 | 1,15 à 1,3 |
(1)La position du signal dépend fortement du solvant et de la concentration.
1.6. À partir des réponses aux questions 1.3 et 1.5, donner la nature de la réaction étudiée.
1.7. Justifier qualitativement que cette réaction puisse être suivie par conductimétrie.
2. Étude de la cinétique de la réaction
Deux mélanges eau / acétone sont étudiés à différentes températures. L’eau est ici en large excès, elle intervient donc comme solvant et comme réactif. Les conditions opératoires sont résumées dans le tableau ci-dessous :
| Eau | Acétone | 2-chloro-2-méthylpropane | Température (°C) |
| Expérience A1 | 30 g | 20 g | 1,0 mL | 25 |
| Expérience A2 | 30 g | 20 g | 1,0 mL | 30 |
| Expérience A3 | 30 g | 20 g | 1,0 mL | 40 |
| Expérience B | 25 g | 25 g | 1,0 mL | 40 |
Le mélange eau / acétone est introduit dans un bécher de 100 mL qui est placé dans un bain thermostaté. Lorsque la température à l’intérieur du bécher est stabilisée à la valeur désirée, une sonde conductimétrique est introduite puis 1,0 mL de 2-chloro-2-méthylpropane est versé dans le milieu réactionnel sous agitation. Au bout de quelques secondes, l’agitation est stoppée puis la conductivité de la solution est suivie au cours du temps à l’aide d’un système informatisé. La durée de l’acquisition est de 20 minutes pour chaque étude.
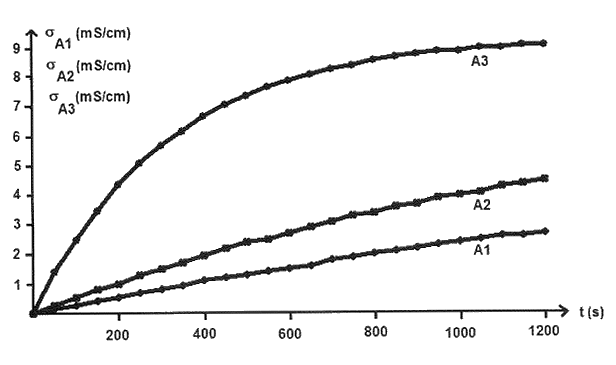
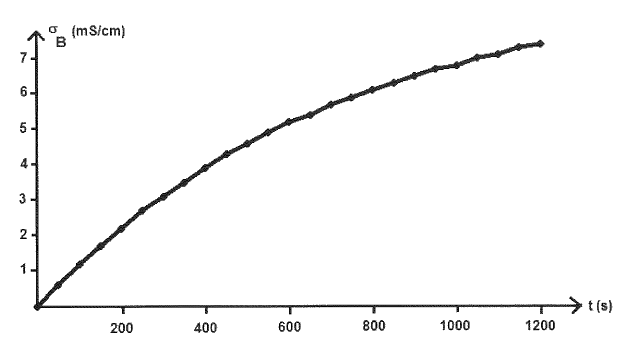
On suppose que : σ(t) = K x(t)
σ(t) représente la conductivité de la solution à un instant donné à laquelle a été retranchée la conductivité initiale de la solution, K est une constante qui va dépendre du mélange considéré et de la température et x(t) représente l’avancement de la réaction à un instant donné. Les graphes, placés sur l’annexe, représentent σ(t) en fonction du temps pour différentes conditions expérimentales.
2.1. En comparant les expériences A1, A2 et A3 et en justifiant brièvement, indiquer l’influence de la température sur la vitesse de la réaction.
2.2. En comparant A3 et B, indiquer l’influence de la proportion eau / acétone sur la vitesse de la réaction chimique. Justifier la réponse.
2.3. Définir le temps de demi-réaction.
2.4. Donner la valeur du temps de demi-réaction dans le cas de l’expérience A3.
3. Cinétique relativiste
On imagine que la réaction est réalisée dans la navette spatiale s’éloignant à une vitesse de v = 0,80.c de la Terre où c est la vitesse de la lumière dans le vide. Les élèves enregistrent un temps de demi-réaction de 1000 s dans la navette. Un observateur terrestre peut aussi en déduire une mesure du temps de demi-réaction à l’aide d’un dispositif embarqué dans l’engin qui va envoyer un signal lumineux à deux balises fixes par rapport à la Terre, placées dans l’espace, et munies de deux horloges H1 et H2 synchronisées. Un premier signal est envoyé au début de la réaction et un second lorsque le temps de demi-réaction est atteint. L’horloge H est fixe par rapport à la navette.
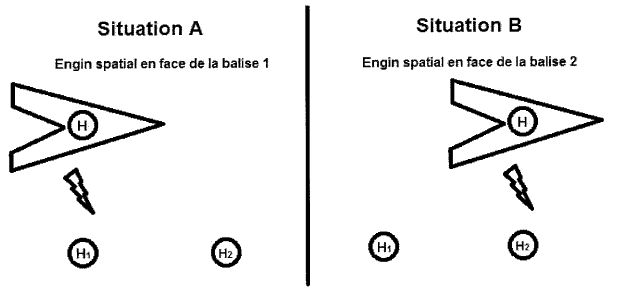
3.1. Définir la notion de temps propre.
3.2. Indiquer les deux référentiels étudiés ici.
3.3. Donner les noms de ∆tm et ∆tp dans la relation ∆tm = γ ∆tp.
3.4. Dans quels référentiels sont déterminés respectivement ∆tm et ∆tp ?
3.5. Quel est le nombre suffisant d’horloge(s) qu’il faut utiliser pour mesurer la durée ∆tp ?
3.6. Sachant que \(\displaystyle\mathrm{ \frac{1}{γ^2}=1- \frac{v2}{c^2} }\) , calculer γ, puis la durée inconnue.
3.7. Comparer ∆tm et ∆tp. Commenter.
3.8. Citer une expérience réaliste qui permet d’observer ce phénomène.
|