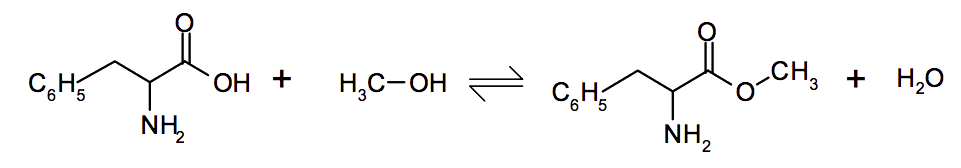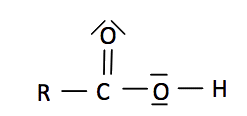Carnet de bac
Annales
Autour de l'aspartame |
|
| Métropole 2013 (remplacement) - Exercice 2 - 10 points |
|
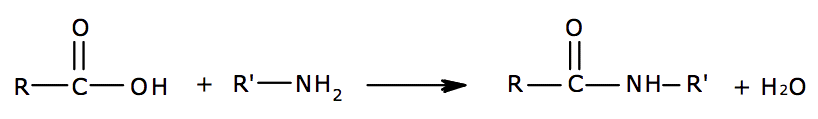
L’aspartame est un édulcorant artificiel découvert en 1965. C’est un dipeptide obtenu par réaction de l’acide aspartique et d’un dérivé de la phénylalanine, deux acides aminés.
Les parties 1, 2 et 3 sont indépendantes. 1. La phénylalanine et l’acide aspartique 1.1. La phénylalanine
La phénylalanine est un acide aminé essentiel : il doit être apporté par l’alimentation car l’organisme est incapable de le synthétiser. La formule de la phénylalanine est :
1.2. L’acide aspartique La formule de l’acide aspartique est : 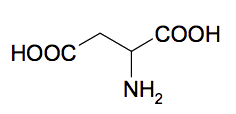
On s’intéresse au spectre de RMN du proton de l’acide aspartique. Le tableau ci-dessous donne les déplacements chimiques de quelques noyaux d’hydrogène. L’hydrogène concerné est indiqué en caractère gras.
Le spectre de RMN de l’acide aspartique présente les signaux suivants :
1.2.1. Attribuer les signaux observés à chaque hydrogène (ou groupes d’hydrogènes équivalents) de la molécule d’acide aspartique. 1.2.2. Interpréter la multiplicité des pics pour le triplet à 3,8 ppm. 2. Synthèse d’un dérivé de la phénylalanine La littérature scientifique permet d’obtenir les informations suivantes : |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Document 1. Protocoles de synthèse du dérivé de la phénylalanine
Protocole n°1 Utilisation du triméthylchlorosilane
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
Document 2 : informations concernant différentes espèces chimiques
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
2.1. À l’aide des documents, dégager l’(es) avantage(s) et l’(es) inconvénient(s) de chacun des trois protocoles proposés. Consigner les réponses dans un tableau.
Protocole retenu :
Données : Masses molaires :
Masses volumiques :
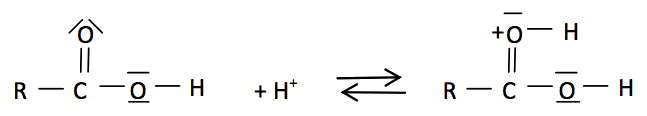
Comparaison des électronégativités : χ(O) > χ(C)
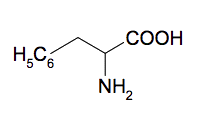
On utilisera la formule simplifiée ci-contre pour la molécule de phénylalanine.
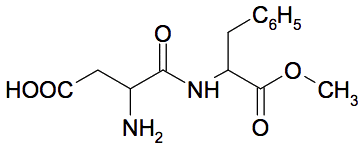
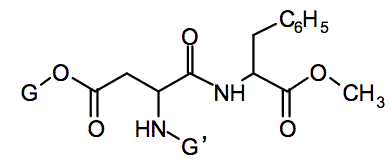
Ainsi l’acide aspartique et l’ester méthylique de la phénylalanine réagissent entre eux pour former l’aspartame dont la formule est donnée ci-dessous :
Table des nombres d’onde
|