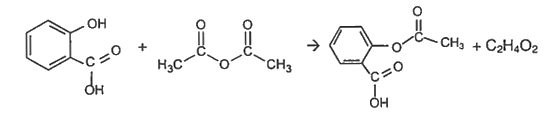Carnet de bac
Annales
Aspirine et prévention cardiovasculaire |
|
| Amérique du nord 2013 - Exercice 1 - 8,5 points |
L’une des propriétés pharmacologiques de l’aspirine est d’être un fluidifiant du sang. C’est pourquoi l’aspirine peut être utilisée de manière préventive pour diminuer le risque de formation de caillots sanguins responsables des accidents vasculaires cérébraux (AVC). L’aspirine est alors prescrite à faible dose : 75 à 150 mg/jour.
|
||||||||||||||||||
|
Protocole
|
||||||||||||||||||
1.1. Obtention de l’aspirine :
|
||||||||||||||||||
|
Document 1 : Matériel disponible pour effectuer la chromatographie.
Plaques pour CCM – capillaires – éluant – cuve à chromatographie – aspirine pur du commerce dissous dans un solvant – acide salicylique pur dissous dans un solvant – lampe UV ou solution de permanganate de potassium. |
||||||||||||||||||
|
1.2.2. Quelles particularités doit présenter le chromatogramme obtenu avec le dernier prélèvement, en admettant que le système réactionnel est alors dans son état final ?
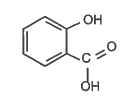
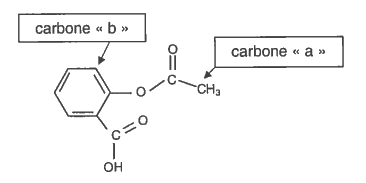
2. Analyse spectrale des espèces chimiques intervenant dans la synthèse de l’aspirine 2.1. Spectre RMN de la molécule d’aspirine. 2.1.1. Recopier la formule de la molécule d’aspirine et identifier les deux groupes caractéristiques dans cette molécule. Les nommer. 2.1.2. Deux carbone particuliers sont repérés par les lettres « a » et « b » dans la formule de la molécule d’aspirine reproduite ci-dessous :
|
||||||||||||||||||
|
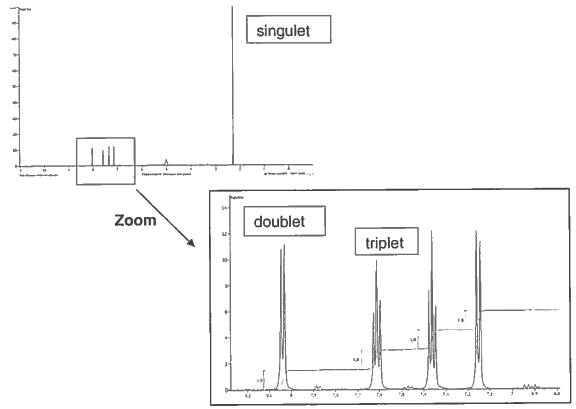
Document 2 : Spectre RMN de la molécule d'aspirine
|
||||||||||||||||||
|
2.2. Spectre IR de la molécule d’acide éthanoïque.
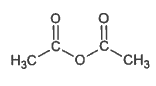
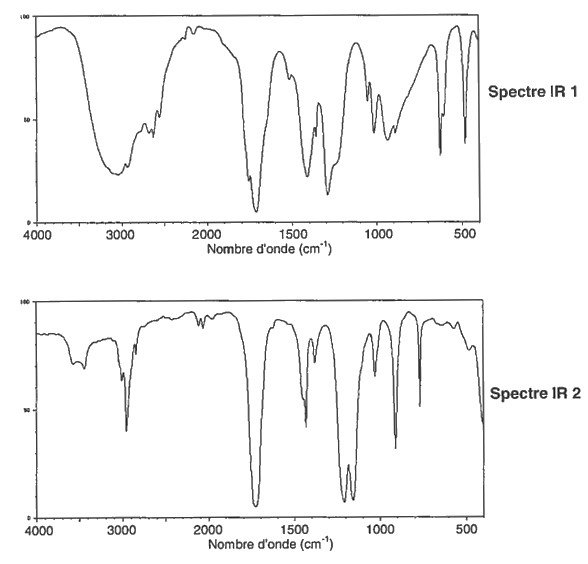
L’autre produit issu de la synthèse de l’aspirine est l’acide éthanoïque de formule brute C2H4O2. 2.2.1. Donner la formule semi-développée de l’acide éthanoïque et du méthanoate de méthyle qui est un isomère de l’acide éthanoïque. 2.2.2. Les spectres infrarouges de ces deux espèces chimiques sont regroupés dans le document 3 ci-dessous. Une table de données de spectroscopie infrarouge est également fournie (document 4). Identifier celui qui appartient à l’acide éthanoïque en justifiant. |
||||||||||||||||||
|
Document 3 : Spectres IR de l'acide éthanoïque et du méthanoate de méthyle
|
||||||||||||||||||
Document 4 : Table de données pour la spectroscopie IR
|
||||||||||||||||||
|
3. Dosage d’un sachet d’aspirine
L’étiquette d’un sachet d’aspirine prescrit au titre de la prévention des AVC porte la mention : « Teneur en aspirine : 100 mg »
|
||||||||||||||||||
|
Catalgine (acétylsalicylate de sodium)
- Le médicament est soluble dans l’eau et l’ingestion est facilitée. - Dans l’estomac, dont le pH est très acide, les ions acétylsalicylate réagissent avec les ions H3O+ pour redonner de l’aspirine moléculaire qui précipite. Ce précipité, obtenu sous forme de grains microscopiques, est plus facilement assimilable. |
||||||||||||||||||
L’aspirine ou (acide acétylsalicylique) possède une base conjuguée, l’ion acétylsalicylate. Le pKa du couple acide/base ainsi constitué est égal à 3,5.
|
||||||||||||||||||