Carnet de bac
Annales
Acide lactique et médecine animale |
|
| Liban 2013 - Exercice 1 - 7 points |
|
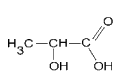
Des tests d’effort sont pratiqués par des vétérinaires afin d’évaluer la condition physique des chevaux. Celle-ci est liée à l’apparition d’acide lactique dans les muscles pouvant entraîner des crampes douloureuses après un exercice physique prolongé. L’acide lactique est également à la base de la fabrication d’un polymère biodégradable, l’acide polylactique, utilisé en chirurgie vétérinaire pour réaliser des sutures.
| ||||||||||||
|
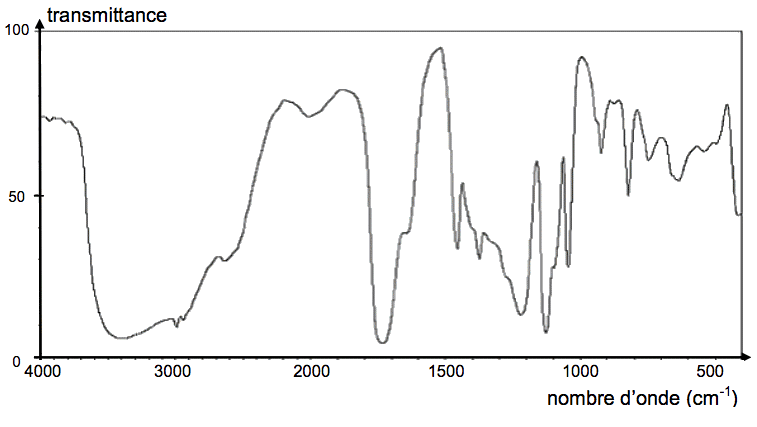
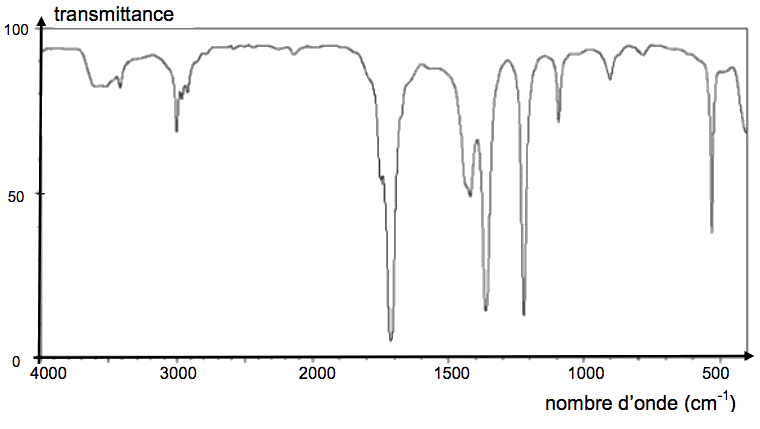
Document 1 : Spectres IR
Spectre IR n°1
| ||||||||||||
|
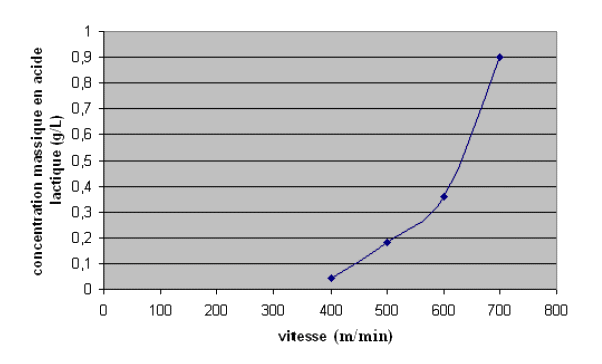
2. Test d’effort d’un cheval
| ||||||||||||
|
Document 2 : Concentration massique en acide lactique à l’issue de différentes phases d’un test d’effort en fonction de la vitesse, pour un test réalisé trois semaines auparavant
| ||||||||||||
|
Document 3 : « paramètre V4 »
Le « paramètre V4 » est défini par la valeur de la vitesse qui correspond à une concentration en acide lactique de 0,36 g·L-1. Ce paramètre est assimilable à un seuil de fatigue. Il dépend de l’âge du cheval, de son niveau d’entraînement et de sa capacité individuelle à l’effort. D’après Pégase.Mayenne | ||||||||||||
|
3. Polymérisation de l’acide lactique
| ||||||||||||
|
Document 4 : Protocole de synthèse de l’acide polylactique
- Introduire environ 10 mL d’acide lactique pur dans un bécher. - Ajouter délicatement quelques gouttes d’acide sulfurique à l’aide de gants et de lunettes de protection. - Chauffer à 110°C en agitant régulièrement. - Au bout d’environ trente minutes, laisser refroidir le mélange qui se solidifie mais reste transparent : il s’agit de l’acide polylactique. D'après Académie de Nancy | ||||||||||||
|
3.1. La polymérisation de l’acide lactique est-elle lente ou rapide ? Justifier.
|
||||||||||||