|
Le polystyrène et le polystyrène expansé sont des matériaux fréquemment utilisés dans le domaine de l’isolation et de l’emballage. Ces polymères sont synthétisés à partir d’une même molécule, le styrène. Le styrène est disponible auprès des fournisseurs spécialisés sous la forme d’un liquide commercialisé pur ou dilué dans un solvant spécifique.
Données :
- Produit commercial étudié et extrait de l’étiquette figurant sur la bouteille :

- Électronégativités (de Pauling) pour les atomes d’oxygène : 3,5 et d’hydrogène : 2,1 ;
- Température de fusion de l’éthylbenzène : – 95°C ; température d’ébullition de l’éthylbenzène : 136 °C ; température de fusion des oxydes de zinc : 1975 °C ;
- Produit ionique de l’eau à 25°C : Ke = 1,0·10-14.
1. Obtention industrielle du styrène
Le styrène fut célébré par Raymond Queneau dans un poème en alexandrins intitulé « le chant du styrène » dont un extrait est reproduit ci-dessous :
« Le styrène est produit en grande quantité
À partir de l’éthylbenzène surchauffé.
Faut un catalyseur comme cela se nomme
Oxyde ou bien de zinc ou bien de magnésium.»
La voie de synthèse du styrène, évoquée dans le poème, est la déshydrogénation de l’éthylbenzène, produit issu de la pétrochimie. Cette transformation peut être modélisée par la réaction d’équation suivante :
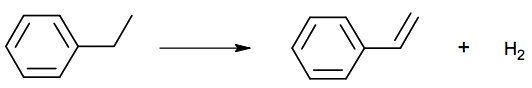
1.1. Cette réaction correspond-elle à une modification de chaîne ou à une modification de groupe caractéristique ?
1.2. Parmi les trois grandes catégories de réactions en chimie organique, déterminer à quelle catégorie appartient cette réaction.
1.3. Le poème indique que cette transformation chimique nécessite l’emploi de catalyseurs. Définir un catalyseur.
1.4. Dans le cas de la synthèse du styrène, déterminer si la catalyse est homogène, hétérogène ou enzymatique.
2. Préparation du styrène avant utilisation au laboratoire
Le styrène, sensible à la lumière et aux températures élevées, peut se polymériser dans la bouteille en l’absence de précaution. Pour éviter cela, la solution de styrène est « stabilisée » par ajout d’un inhibiteur de polymérisation : le 4-tert-butylpyrocatéchol de formule topologique suivante :
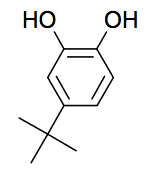
Avant utilisation, il est donc nécessaire d’éliminer l’inhibiteur de polymérisation. Pour cela, le protocole suivant est mis en œuvre :
- Sous une hotte ventilée, dans une ampoule à décanter, verser 10 mL du produit commercial à purifier contenant le styrène et le 4-tert-butylpyrocatéchol.
- Ajouter 10 mL de solution d’hydroxyde de sodium (Na+(aq) + HO-(aq)) de concentration molaire 1,0 mol·L-1.
- Boucher, agiter l’ampoule, dégazer puis laisser décanter.
- Observer les changements de couleur des deux phases. Éliminer la phase aqueuse.
- Laver la phase organique recueillie avec 20 mL d’eau.
- Récupérer la phase aqueuse dans un bécher et mesurer son pH. Recommencer le lavage à l’eau jusqu’à obtention d’un pH proche de la neutralité.
- Placer le styrène extrait dans un erlenmeyer et ajouter une spatule de chlorure de calcium anhydre.
- Filtrer le mélange et récupérer le styrène purifié.
2.1. Réalisation du protocole
2.1.1. Les consignes de sécurité indiquées pour mettre en œuvre ce protocole vous paraissent-elles justifiées ?
2.1.2. Proposer d’autres précautions à prendre afin de manipuler en toute sécurité.
2.2. Identifier les groupes caractéristiques présents dans la molécule de 4-tert-butylpyrocatéchol.
2.3. Déterminer la polarisation de la liaison O-H. Justifier que l’on trouve dans les tables de données deux pKA, respectivement 9 et 13, pour le 4-tert-butylpyrocatéchol.
2.4. Écrire les deux couples acide-base issus du diacide en notant H2A le 4-tertbutylpyrocatéchol. Établir un diagramme de prédominance faisant intervenir les deux couples.
2.5. Estimer la valeur du pH de la solution d’hydroxyde de sodium utilisée pour le lavage.
2.6. Écrire l’équation de réaction mise en jeu entre le 4-tert-butylpyrocatéchol noté H2A et les ions hydroxyde HO͞ , si les ions hydroxyde sont en large excès.
2.7. Expliquer pourquoi le lavage par la solution d’hydroxyde de sodium du produit commercial contenant le styrène permet d’éliminer le 4-tert-butylpyrocatéchol.
2.8. En schématisant l’ampoule à décanter, indiquer dans quelle phase se trouve le styrène et dans quelle phase se situe le 4-tert-butylpyrocatéchol.
2.9. Expliquer le rôle des lavages supplémentaires à l’eau et du contrôle du pH.
2.10. Expliciter le rôle du chlorure de calcium anhydre.
3. Contrôle de la teneur en styrène dans le flacon commercial
Le produit commercial utilisé indique que le pourcentage massique de styrène est de 42 %. Toutefois, compte tenu des difficultés qui peuvent être rencontrées lors de la conservation du styrène, il est recommandé de déterminer sa concentration avant de l’utiliser. On réalise pour cela une mesure d’absorbance du styrène à l’aide d’un spectrophotométre UV-visible et on exploite cette mesure à l’aide d’un graphe fourni par le fabricant.
Spectre d’absorption du styrène :
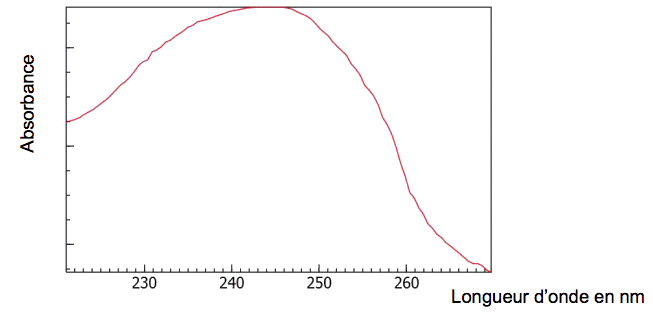
3.1. À quelle longueur d’onde la mesure d’absorbance devra-t-elle être réalisée ? Dans quel domaine les ondes correspondantes appartiennent-elles ?
3.2. D’après le graphe suivant fourni par le fabricant, quelle relation peut-on écrire entre l’absorbance A de la solution et sa concentration C en styrène ? À quelle loi empirique cette relation fait-elle référence ?
Graphe fourni par le fabricant du produit étudié :
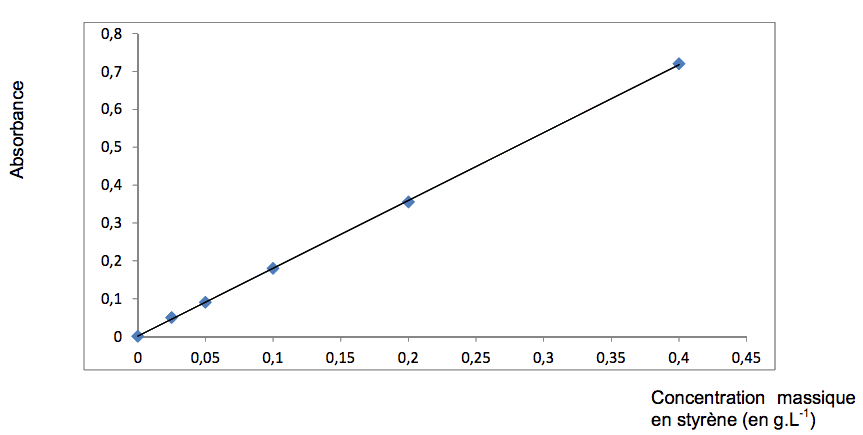
3.3. Proposer un protocole détaillé permettant d’obtenir précisément le graphe A = f(C) fourni par le fabricant du produit.
3.4. On prélève alors une masse m = 10 mg de résine dans le flacon du produit commercial étudié. Puis, dans le même solvant que celui utilisé pour obtenir le graphe, on dissout ce prélèvement pour former une solution de volume 50,0 mL. La mesure de l’absorbance de l’échantillon obtenu conduit à une valeur de 0,15. Déterminer si le styrène s’est bien conservé.
|