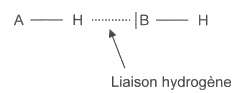|
L'acide fumarique est un compose synthétisé normalement par la peau lorsque celle-ci est exposée au Soleil. Lorsque ce processus est déficient, l’être humain développe une maladie de la peau : le psoriasis. Le psoriasis touche près de 5 % de la population, il n'existe malheureusement aucun traitement pharmaceutique réellement efficace. Cependant, l‘acide fumarique et certains de ses dérives ont été utilisés avec un succès mesurable, en Europe du Nord et aux États-Unis, depuis plus de 30 ans, pour calmer les démangeaisons, la desquamation et l‘inconfort caractéristiques du psoriasis. Des gélules contenant de l‘acide fumarique peuvent être ingérées quotidiennement.
L’objectif de cet exercice est d’étudier quelques caractéristiques physico-chimiques de l’acide fumarique et d’effectuer un contrôle qualité des gélules vendues pour le traitement nutritionnel du psoriasis.
1. Caractéristiques physiques de l’acide fumarique
L’acide fumarique a pour formule topologique : 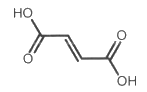
|
Acide maléique |
Acide fumarique |
| Nom officiel |
Acide(Z)-but-2-ène-1,4-dioique |
Acide(E)-but-2-ène-1,4-dioique |
| Aspect |
Solide blanc |
Solide blanc |
| Utilisations |
Synthèse de polyesters
Présent dans certains détergents |
Traitement du psoriasis
Additif alimentaire en tant qu’acidifiant |
| Masse molaire (g·mol–1) |
116 |
116 |
Solubilité avec l’eau à 25 °C
(La solubilité est la masse
maximale d’un composé que
l’on peut dissoudre par litre de solvant) |
Très grande : 780 g·L–1 |
Très faible : 6,3 g·L–1 |
| Température de fusion |
131 °C |
287 °C |
| Masse volumique |
1,59 g·cm–3 |
1,63 g·cm–3 |
| Pictogramme de sécurité |
 |
 |
| pKa |
pKa1 (AH2/ AH–) = 1,83
pKa2 (AH– / A2–) = 6,59 |
pKa1 (AH2/ AH–) = 3
pKa2 (AH– / A2–) = 4,4 |
1.1. Représenter les formules topologiques de l’acide fumarique et de l'acide maléique en faisant apparaître ce qui les distingue.
1.2. Ces deux stéréoisomères sont-ils des énantiomères ou des diastéréoisomères ? Justifier votre réponse.
1.3. Peut-on différencier expérimentalement les deux stéréoisomères dans un laboratoire de lycée ? Justifier et décrire une expérience possible.
1.4. Les différences de propriétés physiques et chimiques entre l’acide fumarique et l’acide maléique peuvent s’interpréter, au niveau microscopique, à l’aide des liaisons hydrogène. Une liaison hydrogène se forme lorsqu’un atome d’hydrogène H est lié à un atome A, très électronégatif, et interagit avec un atome B, également très électronégatif et porteur d'un ou plusieurs doublets d’électrons non liants.
Pour que ces liaisons puissent s‘établir, les atomes doivent être proches. On les représente par un trait pointillé comme ci-dessous.
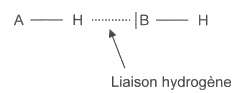
On donne l‘électronégativité de quelques atomes : H : 2,2 ; C : 2,6 ; O : 3,4. On considère qu’une liaison est polarisée dès lors que la différence d’électronégativité entre les deux atomes est supérieure à 0,5.
1.4.1. Expliquer, à l’aide de schémas, pourquoi l'acide fumarique ne donne que des liaisons hydrogène intermoléculaires, alors que l'acide maléique peut donner des liaisons hydrogène intermoléculaires et intramoléculaires.
1.4.2. En déduire pourquoi les températures de fusion des deux acides sont différentes.
1.5. Indiquer, en le justifiant, si l’eau est un solvant polaire ou apolaire.
1.6. Sachant que |’acide maléique est polaire tandis que l’acide fumarique est apolaire, proposer une explication à la différence de solubilité dans l‘eau de ces deux stéréoisomères.
2. Propriétés chimiques de l’acide fumarique

Pour étudier les propriétés acides de l’acide fumarique en solution aqueuse, on dissout 500 mg d’acide fumarique du laboratoire dans de l’eau distillée pour obtenir une solution de volume 100,0 mL. La mesure du pH de la solution donne pH = 2,4.
2.1. Décrire précisément le protocole pour réaliser cette solution.
2.2. Rappeler la définition d’un acide au sens de Brönsted.
2.3. L’acide fumarique possède des propriétés acido-basiques en solution aqueuse. Expliquer pourquoi cette molécule est qualifiée de diacide.
2.4. Calculer la concentration molaire CA apportée de l'acide fumarique dans la solution préparée.
2.5. Un diacide fort de concentration molaire C a un pH = – log (2 C). L’acide fumarique est-il un diacide fort ?
2.6. Durant la digestion, le pH de l'estomac est voisin de 2. En déduire sous quelle forme se trouve l'acide fumarique dans l’estomac.
3. Contrôle qualité d'un traitement nutritionnel à base d’acide fumarique

On se propose de vérifier l’indication portée sur l’étiquette d’un traitement du psoriasis, à l’aide d'un titrage acido-basique, selon le protocole suivant :
- À l’aide d’un mortier, réduire en poudre le contenu d'une gélule.
- Dissoudre la poudre obtenue dans de l’eau distillée de manière à obtenir un volume V = 100,0 mL de solution.
- Effectuer une prise d’essai de volume VA = 10,0 mL de la solution.
- Titrer par une solution d’hydroxyde de sodium (Na+(aq) + HO–(aq)) de concentration molaire CB = 1,0·10–1 mol·L–1.
- Suivre l’évolution du pH en fonction du volume versé.
L'équation de la réaction, support du titrage, est la suivante :
AH2(aq) + 2 HO–(aq) → A2 - (aq) + 2 H2O(ℓ)
La courbe d‘évolution du pH en fonction du volume de solution versé est donnée ci-dessous
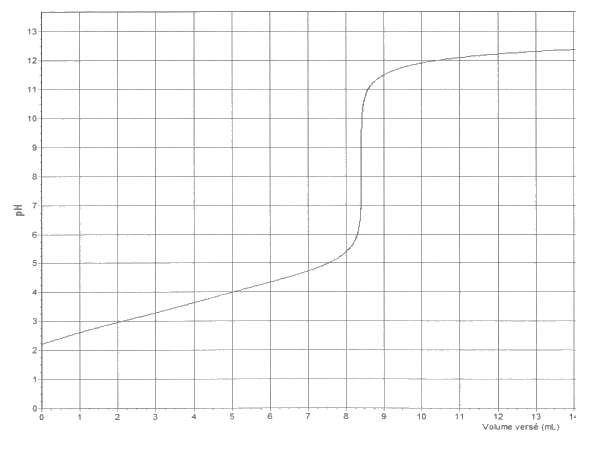
3.1. Avec quelle verrerie doit-on effectuer le prélèvement de la solution titrée ?
3.2. Schématiser et légender le dispositif expérimental réalisé.
3.3. Déterminer, en explicitant votre démarche, la valeur expérimentale mexp de la masse d‘acide fumarique contenu dans une gélule. L’incertitude relative \(\displaystyle\mathrm{ \frac{U(m_{exp})}{m_{exp}} } \) dans les conditions de l’expérience, est donnée par la relation :
$$\mathrm{ \left( \frac{U(m_{exp})}{m_{exp}} \right)^2 =\left( \frac{U(V_A)}{V_A} \right)^2 + \left( \frac{U(V_E)}{V_E} \right)^2 + \left( \frac{U(C_B)}{C_B} \right)^2 } $$
Incertitude sur un volume mesuré à la burette graduée : ± 0,1 mL
Incertitude sur un volume mesuré à la pipette jaugée : ± 0,1 mL
Incertitude sur un volume mesuré à la pipette graduée : ± 0,2 mL
Incertitude sur la concentration de la solution d'hydroxyde de sodium : ± 0,3·10–2 mol·L–1.
3.4. Quelle source d’erreur apporte la plus grande contribution à l’incertitude associée au résultat expérimental ?
3.5. Donner un encadrement de la masse mexp, d’acide fumarique contenu dans une gélule dans le cas d’un prélèvement à la pipette jaugée. Commenter.
3.6. Parmi les trois indicateurs colorés suivants, lequel est le plus approprié pour effectuer le titrage de l’acide fumarique ? Justifier la réponse.
| Indicateur coloré |
Teinte acide |
Zone de virage |
Teinte basique |
| Hélianthine |
Rouge |
3,1 - 4,4 |
Jaune |
| Rouge de crésol |
Jaune |
7,2 - 8,8 |
Rouge |
| Jaune d’alizarine R |
Jaune |
10,1 – 12,1 |
Violet |
|